从CHO到HEK293:一文读懂悬浮细胞培养技术的关键步骤与未来趋势
发布时间:2025-12-15 浏览次数:27
悬浮细胞培养技术的核心机制是营造适宜的流体动力学环境,使哺乳动物细胞无需借助固相支撑物,就可以在液体培养基中自由生长增殖。
该技术打破了传统贴壁培养对细胞生长空间的局限,凭借生物反应器的混合与通气系统保障细胞在悬浮状态下的均匀分布,并保持代谢平稳。搅拌速度与溶氧浓度处于适宜区间时细胞可维持较强活性与增殖效能,为高密度培养的达成提供重要前提。
悬浮培养系统中细胞的生长动力学存在特定的变化模式。
培养初期,细胞需适应悬浮状态,对数生长期内,细胞快速增殖最终进入稳定阶段。
通过优化培养参数及营养供给状况能够有效延长细胞对数生长期时长,获得更高的细胞密度。这类悬浮培养方式符合工业化生产需求,已成为现代哺乳动物细胞培养领域的核心技术。
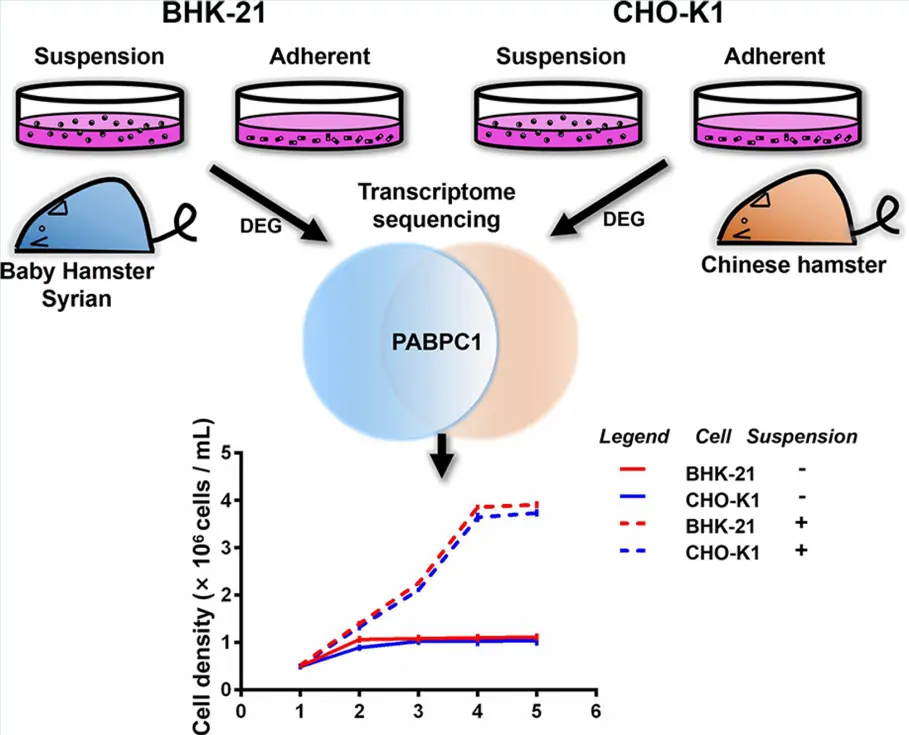
图1 PABPC1促进BHK-21与CHO-K1悬浮细胞增殖
一、培养系统的核心要素
构建高效的悬浮培养体系需充分考量多项关键技术要素。其中,细胞系的筛选及驯化是核心基础步骤。CHO、HEK293等常用细胞系,经系统化驯化后可顺利适配悬浮生长条件。驯化过程需逐步推进保障细胞活力持续维持在90%以上。
在培养基优化方面,需要重点关注以下几个要点:
- 基础培养基组成:现代哺乳动物细胞培养普遍采用化学成分明确的无血清培养基,并根据细胞代谢特征精确调整营养成分比例。
- 特殊添加剂:添加适宜浓度的氨基酸和维生素,有效支持细胞的高密度生长与产物表达。
- 保护性成分:如泊洛沙姆等保护剂,可减轻流体剪切力造成的损伤,增强细胞对机械应力的耐受能力。
二、过程控制的关键参数
实现高密度悬浮培养需精确控制多项关键参数。其中,溶解氧浓度的调控尤为关键,通常需维持在约40%的饱和浓度。充足的氧气供应能有效防止高密度培养时细胞聚集体中心出现坏死。
在参数控制过程中,需特别关注以下方面:
- 温度控制:多数哺乳动物细胞的最适生长温度为35–37℃,精确控温对维持细胞正常代谢至关重要。
- pH稳定性:通过精确调控CO2浓度和碳酸氢钠添加量,将培养体系的pH稳定在6.8–7.3的适宜范围内。
- 搅拌优化:适当的搅拌确保培养基成分均匀分布,但应避免过大的剪切力,搅拌速率通常设置在150–250 rpm范围内。
三、规模化工艺策略
将悬浮培养从实验室规模成功放大至工业规模,需要系统化的工艺优化策略。采用分级扩培方法可实现平稳放大,通常包括摇瓶、小型生物反应器和生产规模生物反应器三个阶段。
在培养模式选择方面,不同工艺策略各有特点。悬浮培养工艺按培养方式可分为分批培养、流加培养和灌注培养。

对于贴壁依赖型细胞,微载体悬浮培养工艺提供了一种有效的规模化解决方案。微载体既为细胞提供贴壁表面,又保留了悬浮培养的优势,如环境均一、操作简便和易于放大。
四、应用前景与发展趋势
悬浮培养技术在生物制药领域展现出广阔的应用前景。随着精准医疗的发展,市场对高质量生物制剂的需求持续增长。悬浮细胞培养系统因其良好的可控性,已成为生产单克隆抗体和病毒疫苗的首选平台。
未来的发展趋势主要体现在以下几个方面:
过程智能化:通过引入先进的过程分析技术,实现培养过程的精准控制与优化。
设备创新:新型生物反应器设计的创新,如一次性生物反应器的广泛应用,简化了操作流程。
培养基开发:基于细胞代谢组学研究,开发更为精准的个性化培养基配方。
细胞工程:通过基因工程技术改造细胞系,提升其对悬浮细胞培养环境的适应能力。
这些技术的融合与创新,将共同推动哺乳动物细胞培养技术迈向新高度。
引用文献:
1、Dai X, Miao Y, Han P, Zhang X, Yang S, Lv Q, Hua D. PABPC1 Enables Cells with the Suspension Cultivation Feature. ACS Synth Biol. 2021 Feb 19;10(2):309-317.
2、姚鸿,崔乃香,谭文松,等.悬浮MDCK-STAT1-KO工程细胞的流感病毒生产过程研究[J].中国生物工程杂志,2025,45(05):1-12.
3、Watanabe S, Ichikawa Y, Konishi K, et al. Non-contact culturing of vascular endothelial cells on wall surface following retention using acoustic radiation force and lipid bubbles. Biomed Microdevices. 2025 Oct 31;27(4):50.

了解更多FAQ
Q1. 悬浮培养与贴壁培养在工业化生产中的成本差异主要体现在哪些方面?
悬浮培养与贴壁培养的成本差异集中在三个核心维度:
设备投入,悬浮培养依赖生物反应器的混合、通气系统,初期设备采购与调试成本高于贴壁培养的培养瓶/皿体系,但规模化后单位体积产能更高,摊薄长期成本。
耗材与培养基消耗,悬浮培养需无血清定制化培养基,单次耗材成本略高,但贴壁培养需固相支撑物(如培养瓶、微载体),长期耗材损耗与更换成本累计更显著。
人力与空间成本,悬浮培养可通过自动化控制系统减少人工干预,且反应器占地面积小,适合高密度规模化生产,而贴壁培养需更多操作空间与人工周转,规模化后人力成本优势逐渐丧失。
综合来看,小规模生产时贴壁培养成本更低,大规模工业化生产中悬浮培养的成本效益更突出。
Q2. 不同常用哺乳动物细胞系(如CHO、HEK293)在悬浮驯化过程中面临的核心难点有何差异?
CHO细胞与HEK293细胞的悬浮驯化难点存在明显差异:
CHO细胞:核心难点在于维持细胞贴壁依赖性向悬浮适应性的平稳过渡,其原生贴壁属性较强,驯化中易出现细胞聚团规模过大(超过100μm)、活力骤降等问题,且对流体剪切力的耐受度低于HEK293,需更缓慢的搅拌速度梯度调整(通常从50rpm逐步提升)。
HEK293细胞:驯化难点集中在代谢稳定性控制,其适应悬浮环境的速度更快,但易出现营养消耗不均衡、乳酸积累过快等问题,且对培养基中氨基酸比例的敏感度更高,需精准调整谷氨酰胺、天冬氨酸等关键成分浓度,同时需严格控制驯化过程中的溶氧波动,避免因氧限制导致细胞凋亡率上升。
Q3. 除了添加保护性成分,悬浮培养中还有哪些非化学手段可减轻流体剪切力对细胞的损伤?
除化学保护剂外,非化学手段主要通过优化物理环境降低剪切力损伤:
首先是反应器结构设计,采用弧形底部、桨叶式搅拌器(而非涡轮式),减少局部湍流产生的瞬时高剪切力,部分新型反应器还会增设导流筒,使流体形成平稳循环流场;
其次是搅拌参数的动态调控,根据细胞生长阶段调整搅拌速度,对数生长期细胞活性强可适当提高转速,稳定期则降低转速减少机械损伤,同时采用 “低转速 + 高通气量” 的组合模式,避免单一依赖高搅拌保障溶氧;
最后是细胞聚团控制,通过定期轻柔吹打分散小聚团,避免大聚团中心细胞因剪切力集中受损,同时控制接种密度在适宜范围(通常 1×105~5×105 cells/mL),减少细胞间碰撞频率。
这些手段可与化学保护剂协同作用,进一步提升细胞耐受度。
Q4. 悬浮培养规模化生产中,如何有效防控支原体等微生物污染?
规模化悬浮培养的支原体污染防控需建立全流程闭环体系:
原料质控:所有培养基成分、添加剂需经过支原体检测(常用 PCR 法或培养法),血清类成分需进行灭活处理,避免原料携带污染源;
设备与环境消毒:生物反应器每次使用前需进行高温高压灭菌(121℃,30min),管道系统采用CIP在线清洗+SIP在线灭菌组合工艺,培养车间保持Class 8洁净级别,定期进行环境支原体采样监测;
过程监控:培养过程中每隔24~48h取样检测支原体,采用实时荧光定量 PCR 法实现快速筛查,同时监测细胞活力、代谢产物浓度等间接指标,若出现细胞活力异常下降、乳酸积累速率突变,需立即启动污染排查;
应急处理:若确认污染,需立即终止培养,对反应器及相关设备进行彻底消毒,排查污染源头(原料、环境、操作),避免交叉污染。
Q5. 悬浮细胞培养系统生产的生物制品,与原核、酵母表达系统相比,在产物质量属性上有哪些核心差异?
三者的核心质量差异集中在蛋白修饰、空间构象及生物活性三个维度:
糖基化修饰:悬浮细胞培养(哺乳动物细胞)可实现复杂的糖基化修饰(如N-糖链的分支化、唾液酸化),且修饰模式与人体细胞更接近,能避免免疫原性风险,而原核表达系统(如大肠杆菌)无法进行糖基化修饰,酵母表达系统的糖基化修饰为高甘露糖型,易引发人体免疫反应;
空间构象:哺乳动物细胞的内质网和高尔基体功能完善,可帮助目标蛋白(如抗体、酶)正确折叠形成天然空间构象,确保生物活性,原核表达系统易产生包涵体,需复性处理,折叠正确率较低,酵母表达系统也存在部分蛋白折叠错误的问题;
生物活性:悬浮细胞培养生产的生物制品(如单克隆抗体)的抗原结合活性、中和活性通常高于原核和酵母系统,且在体内半衰期更长,治疗效果更优;
杂质控制:哺乳动物细胞表达的产物杂蛋白主要为细胞自身蛋白,易通过层析工艺去除,而原核系统可能残留内毒素,酵母系统可能残留甘露聚糖,增加纯化难度。
因此,对于治疗性生物制品(如抗体、疫苗),悬浮细胞培养系统的产物质量更符合临床应用要求。

本文由环凯生物(bhkbio.com)转载自“卡梅德”公众号,版权归原作者所有,仅供学习参考,如有侵权请联系删除!










