导,我悟了,一直以来铺板不均匀原来是因为它!
发布时间:2025-05-29 浏览次数:358
在细胞培养的科研探索之路上,“铺板为何总不均匀?”“消化传代错用培养基该怎么办?”“缓冲液中酚红、钙镁离子对细胞培养影响几何?”
这些问题如同拦路虎,频频困扰着实验人员。这些正是从细胞培养答疑群中精选出的三大热点疑问,我们将深入剖析,为你揭开细胞培养难题的神秘面纱。
1、铺板不均匀
Q:铺板次日,细胞分布疏密不均,部分区域密度极高,而有的地方却稀疏得很,这究竟是怎么回事?
A:遇到细胞铺板后分布不均的状况,需要抽丝剥茧、分类分析。常见的不均匀类型主要有三种:随机分布不均、边缘多中间少、边缘少中间多。
先来看第一种 —— 随机分布的不均匀。这种情况的 “罪魁祸首”,大概率是铺板前细胞未能充分分散为单细胞悬液。一旦存在细胞团块被接种到孔内,经过一夜生长,这些区域自然就会呈现出细胞过密的现象。
想要规避此类问题,可以从以下三个关键环节进行优化:
1. 精准把控细胞消化:部分细胞对胰蛋白酶极为敏感,消化时极易成片脱落。针对这类细胞,应避免使用含 EDTA 的胰蛋白酶;也可通过稀释胰酶浓度,或者加入胰酶后迅速吸走大部分,仅留少量在瓶内消化,以此精准调控消化进程 。
2. 彻底吹散细胞:离心后的细胞重悬过程中,务必耐心细致地吹打,建议不少于 20 次。在细胞计数时,若发现仍有较多细胞团,必须继续吹打直至细胞充分分散。
3. 及时镜检筛选:完成铺板后,需即刻在显微镜下随机选取多个视野观察。一旦发现有细胞团,该孔细胞应果断舍弃,重新铺板;若多个孔均存在此问题,则需更换新板重新操作。
第二种情况是边缘多中间少,这种现象在孔面积较小的 96 孔板铺板后尤为常见。
当孔的面积特别小、例如96孔板这种,铺板后就常见细胞边缘多中间少的现象。究其原因,主要是孔内液面形成了边缘高、中间低的弯液面,导致表面张力分布不均。如下图所示:
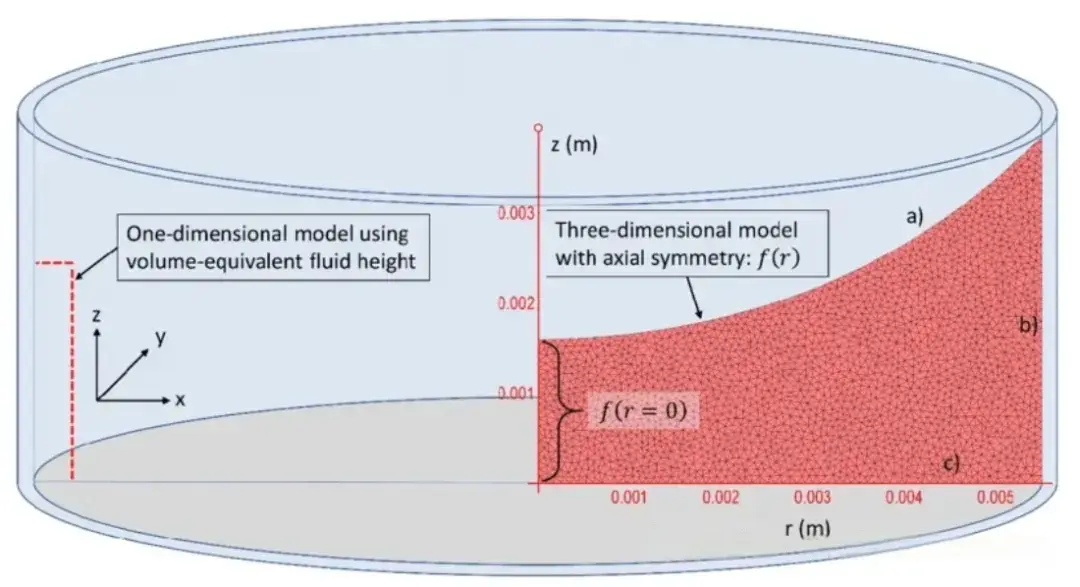
图源:https://www.researchgate.net/figure/a-c-Solutions-of-the-three-dimensional-model-obtained-at-systematically-varied_fig3_350402772
此时,细胞在重力沉降的同时,还会受液体向孔边缘流动的拽力影响,逐渐聚集到边缘区域。
而造成这种结果的操作因素主要有两点:一是孔内液体体积不足,二是液体打出速度过快。
以 96 孔板为例,当孔内液体体积小于 100μL 时,弯液面现象显著;而增加到 200μL 时,细胞分布不均的情况会得到极大改善。
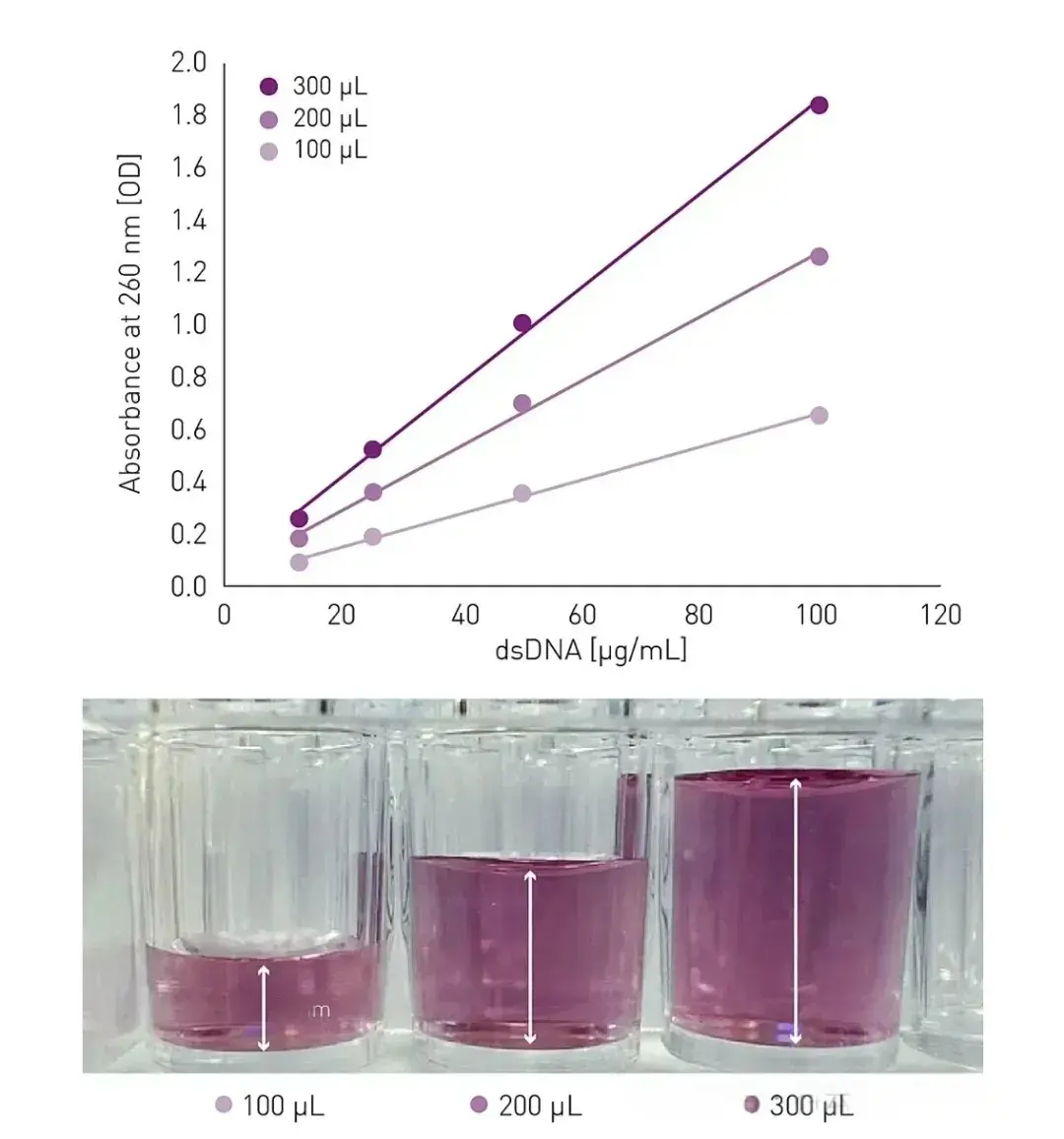
图源:https://www.bmglabtech.com/en/howto-notes/how-to-deal-with-path-length-and-meniscus-in-microplates/
此外,若使用移液器快速将细胞悬液全部冲击到孔内壁,会在局部形成高液面,加剧细胞边缘聚集;
相反,以 50μL / 秒的速度缓慢将液体沿孔壁注入,可促使孔底液面均匀铺展,有效降低弯液面的影响。
对于 24 孔板、6 孔板等较大孔板,虽然弯液面效应相对较弱,但同样要保证足够的液体体积,24 孔板建议加入 1mL 液体,6 孔板则需 3mL。
第三种边缘少中间多的情况,多发生在 6 孔板等培养面积较大的孔板上。
这主要是由于细胞悬液持续冲向孔底部与孔壁连接处的边缘,就像水管对着墙角喷水,水流会反向涌动,使得细胞向打出方向的反方向流动。
由于孔内面积较大,细胞无法直接到达另一端,最终大量聚集在中部区域。
改善方法与上述类似,可降低液体打出速度,让细胞悬液沿孔壁缓缓流入,并增加液体打出的位置,选择 2 - 3 个孔内壁位置分次注入全部液体。
以上就是细胞铺板不均匀的三种情况的对应原因分析和解决办法。不少同学还关心铺板后的混匀操作,即如何摇晃孔板?
在这方面,关键在于把握摇晃力度与静置时长。
对于 96 孔板,可在台面上轻柔地画 “十” 字或 “∞” 字,重复 2 - 3 轮;
而 24 孔板、6 孔板,因孔内液体多、开口面积大,大幅度晃动易导致液体洒出,建议一手扶住孔板一侧,另一手轻轻拍打对侧边缘 5 - 6 次。
无论何种规格的孔板,摇晃后都需静置台面至少 15 分钟。然后再轻轻拿起来、慢慢走到培养箱旁放下,打开培养箱的门后,轻轻拿起培养板、小心放入,再轻轻关上门。
因为我们要让细胞有足够的时间沉到孔底,所以静置的时间要足够,不用担心细胞在外面晾着会不会有问题,不会。我们拿起来孔板走动、放置这些动作都会造成液面波动,因此如果静置时间不够,细胞就会被液体流动带偏了。
2、用错培养基
Q:我的细胞一直用 DMEM培养基培养,消化后不慎使用 1640 培养基进行重悬和培养,这会对细胞有影响吗?
A:对于这种临时用错培养基的情况,需要依据发现时间来分类处理:若在几小时内察觉错误,还有补救机会;若 2 - 3 天后才发现,则需根据细胞类型和状态做进一步判断。
市面上常见的 1640、DMEM、F12 等商品培养基,都是在 MEM 基础培养基配方上改良而来,其差异主要体现在对不同细胞生长的适配性,而非细胞毒性或损伤。
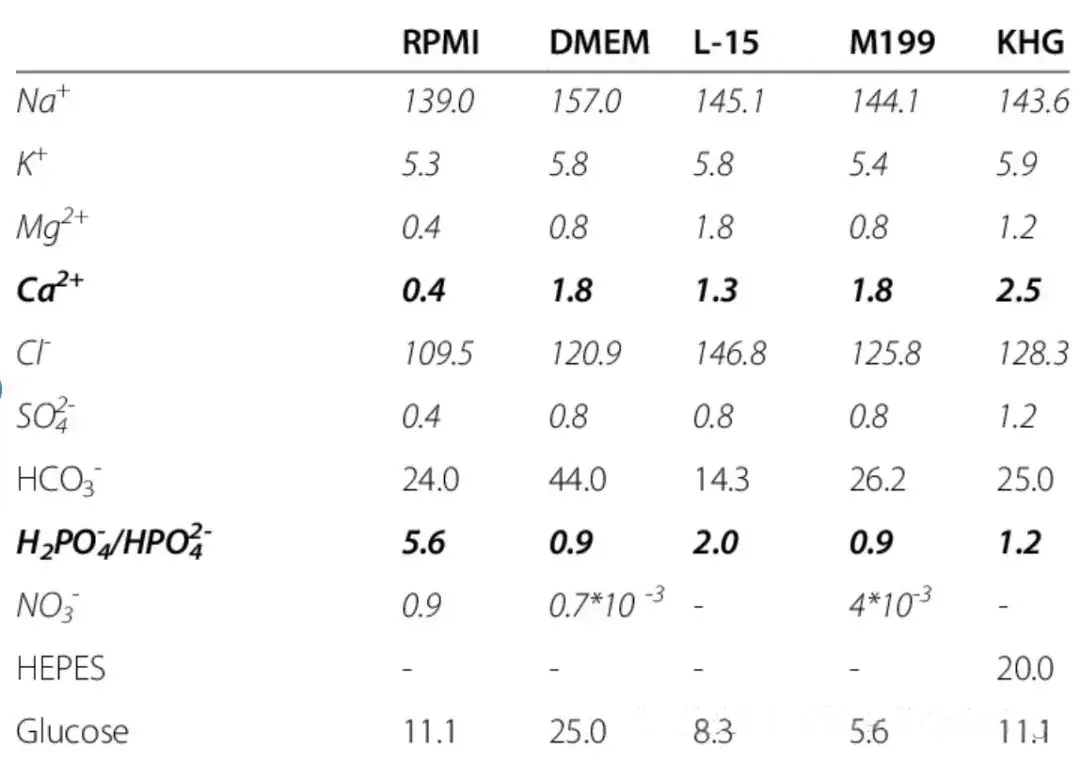
图源:https://www.researchgate.net/figure/Composition-of-different-cell-culture-media-and-Krebs-Henseleit-buffer_tbl3_232224965
若在几小时内发现用错培养基,可将细胞悬液吸出,通过离心去除错误培养基,重新更换正确培养基即可。
若是 2 - 3 天后或次日才发现,此时贴壁细胞大概率已完成贴壁,你可以根据细胞的类型、状态来判断下一步操作。
原代细胞对培养基成分较为敏感,错用培养基可能导致细胞状态变差,出现生长停滞甚至少量死亡,遇到这种情况建议直接弃用;而细胞系通常耐受性较强,一般不会产生严重影响,无需消化细胞,直接更换为正确培养基即可。
3、钙镁/酚红
Q:在选择 HBSS 缓冲液时,面对含钙镁离子 / 不含钙镁离子、含酚红 / 不含酚红等不同规格,该如何抉择?
A:选择 HBSS 缓冲液的关键在于匹配实验需求,我们从离子成分和酚红添加两方面拆解分析。
一、Ca²⁺/Mg²⁺对实验的影响与选择
Ca²⁺和 Mg²⁺是细胞生理活动的 “幕后功臣”:Ca²⁺如同细胞与胶原、纤连蛋白等外基质间的 “黏合剂”,能显著提升细胞贴壁能力;Mg²⁺则作为 ATP 酶、DNA 聚合酶等核心酶的 “助手”,深度参与细胞代谢与信号传导。
若需消化细胞:建议优先使用不含钙镁离子的 HBSS。这是因为胰蛋白酶的活性会受钙镁离子浓度抑制 —— 想象胰酶是把 “剪刀”,而钙镁离子像无形的手束缚住它,导致剪碎细胞间连接的效率降低。此时用无钙镁 HBSS 洗涤,能为消化 “扫清障碍”。
若细胞贴壁不佳:可尝试用含钙镁离子的 HBSS洗涤细胞。通过补充关键离子,增强细胞与基质的黏附力,就像给细胞贴上更牢固的 “双面胶”,改善贴壁状态。
二、酚红的作用与使用场景
酚红是细胞培养中的 “pH 侦察兵”:当环境 pH 为 7.4 时,它呈现标志性红色;pH 下降(如细菌污染导致代谢酸积累),溶液迅速变黄;pH 上升则转为紫色。这一特性使其成为判断细胞状态的 “可视化工具”。
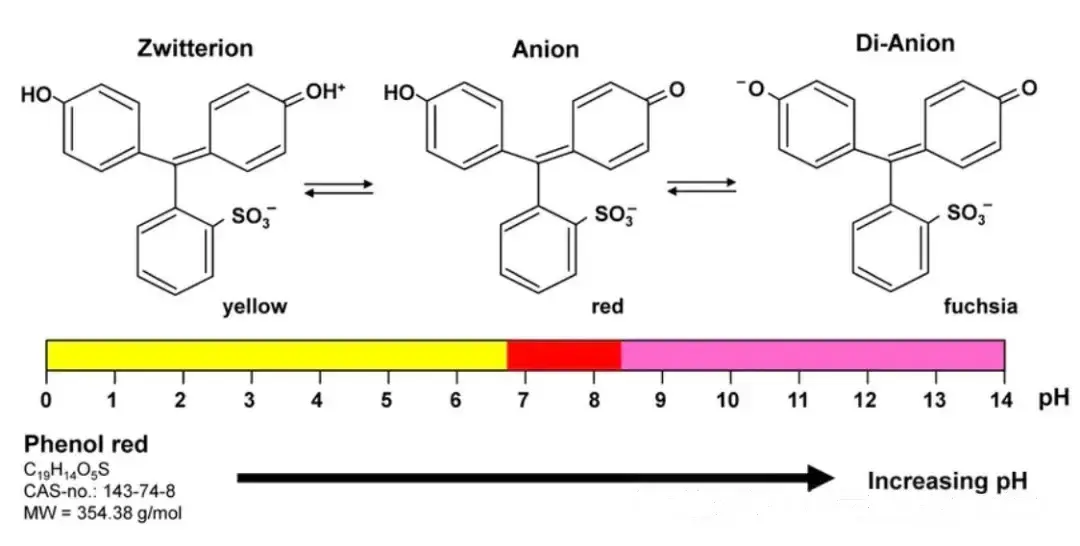
图源:https://www.researchgate.net/figure/Monitoring-pH-changes-in-cell-culture-by-phenol-red-Phenol-red-Phenolsulfonphthalein_fig1_368733721
如果细胞受到细菌污染,培养基就会很快变黄,其主要原因就是培养环境的pH下降得很多,造成酚红变色了。因此,培养基的酚红可以辅助我们判断一些细胞状态。
荧光或流式实验:必须选用不含酚红的 HBSS。酚红的自发荧光如同 “干扰信号”,会掩盖实验观察的真实荧光信号或影响流式细胞术的检测精度。实验前需用无酚红缓冲液彻底洗涤细胞,确保结果不受干扰。
最后再补充一个知识点,就是胰蛋白酶是否含EDTA对细胞消化有什么影响呢?
EDTA通过结合Ca²⁺/Mg²⁺,破坏细胞间连接(如钙黏蛋白依赖的细胞连接),辅助胰酶消化,当面对一些难以消化的细胞时,可以尝试使用含EDTA的胰蛋白酶。
文转载自“科云甄选Coloring”公众号,版权归原作者所有,仅供学习参考,如有侵权请联系删除!






