LDH释放法细胞毒性检测试验
发布时间:2025-09-16 浏览次数:16
实验目的
咱们这个实验的核心目标,是定量评估特定处理(比如药物、化合物或微生物感染)对细胞膜完整性的影响,也就是我们常说的“细胞毒性”。
通过测量培养基中乳酸脱氢酶(LDH)的释放量,你可以精确判断细胞的死亡或损伤程度。
这在药物筛选、评估材料生物相容性等领域是个非常经典且可靠的方法。
实验原理
乳酸脱氢酶(Lactate Dehydrogenase, LDH)是一种稳定存在于细胞质中的酶,像个安分守己的“居家分子”。
在正常情况下,完整的细胞膜会把它牢牢锁在细胞内。
当细胞膜受到损伤或细胞走向死亡时,这道“大门”就破了,LDH便会泄漏到细胞外的培养基中。
那么问题来了,我们怎么“看见”这些跑出来的LDH呢?
咱们利用一个巧妙的酶联反应:释放到培养基中的LDH催化一个反应,产生NADH;接着,在另一种酶(硫辛酰胺脱氢酶)的帮助下,NADH会将一种叫做INT的无色物质还原成红色的甲臜(Formazan)。
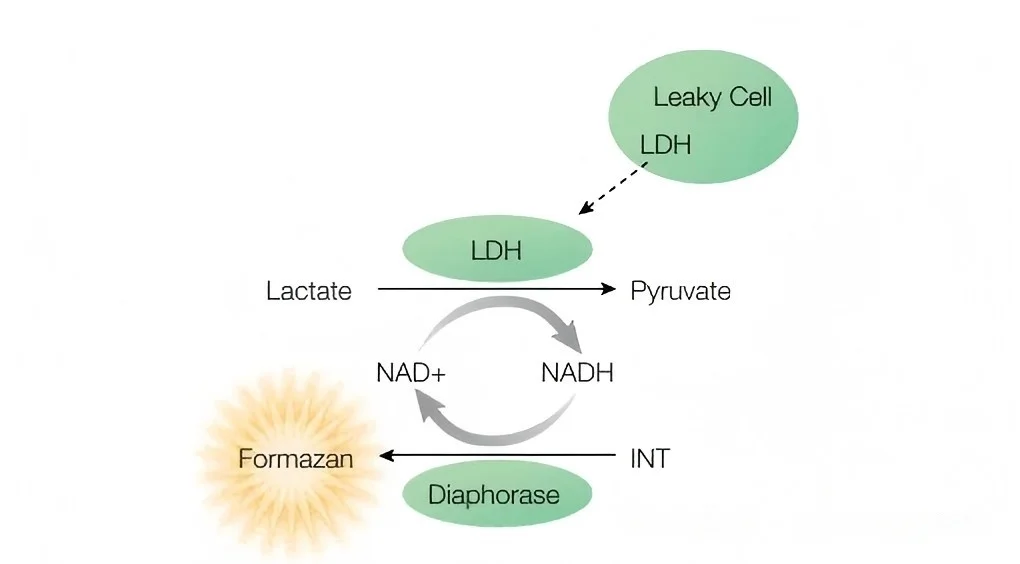
这个甲臜的红色深浅,与释放的LDH量成正比,也就是与死亡的细胞数量成正比。我们用酶标仪在490nm波长下检测这个红色物质的吸光度,就能反推出细胞的死亡情况了。
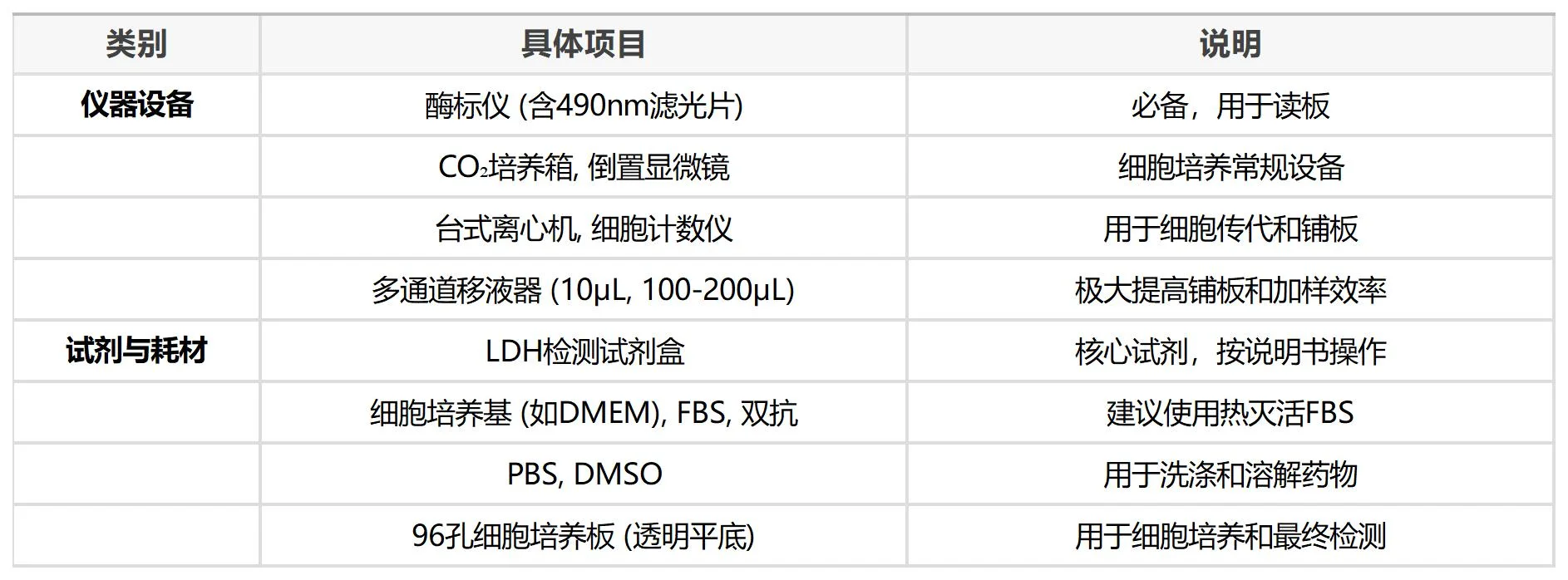
所需材料与试剂
具体操作步骤
1 — Day 1: 细胞准备与铺板
消化状态良好的对数生长期细胞,离心并用新鲜培养基重悬。
准确计数后,将细胞悬液稀释至目标浓度。
在96孔板中每孔加入100 μL细胞悬液,通常细胞密度在3,000到7,000个/孔之间。
将铺好的96孔板放入37℃、5% CO₂的培养箱中培养24小时,让细胞贴壁并恢复状态。
师兄提示:
最佳细胞数需要根据你的细胞类型和药物处理时间来摸索。
处理结束时,空白对照组的细胞密度达到80-90%汇合度是比较理想的状态。(别问我第一次铺得太密结果细胞长老了的惨痛教训)
2 — Day 2: 实验分组与加药处理
吸去旧培养基,用PBS轻柔洗涤细胞一次,然后换上新鲜的低血清(如1% FBS)或无血清培养基。
敲黑板!
血清本身含有LDH,会造成很高的背景值。
所以,强烈建议使用低血清或无血清培养基进行药物处理。
如果必须用高浓度血清,对照组的设置就至关重要了!
在显微镜下观察细胞状态,确保细胞生长均匀。接下来,咱们来设置分组,这是实验成败的关键。
2.1、设置对照组:至少需要设置 样品背景孔 (无细胞,只有培养基)、细胞自然死亡孔 (有细胞,无药物处理) 和 最大酶活性孔 (有细胞,无药物,但在检测前1小时加入裂解液)。
2.2、设置实验组:配制一系列浓度梯度的待测药物溶液,加入到对应的细胞孔中。每个浓度至少设置3个复孔。
将加好药的培养板放回培养箱,根据你的实验设计,继续培养适当的时间(如6, 12, 24, 或48小时)。
3 — Day 3/4: 样品收集与准备
在预定检测时间点前约1小时,从培养箱取出细胞板。
向“最大酶活性对照组”的孔中加入10 μL细胞裂解液(通常是试剂盒自带的),轻柔吹打混匀,然后放回培养箱继续孵育1小时。这一步是给咱们的实验数据定一个“100%死亡”的上限。
到达预定时间后,取出培养板。将培养板在400 g下离心5分钟,目的是让所有细胞或细胞碎片沉到孔底。
小心地从每个孔中吸取90 μL上清液,转移到一个新的96孔板中对应的孔位。注意,千万不要吸到孔底的细胞沉淀!
操作要领!
吸取上清的动作一定要轻柔、缓慢,枪头不要插得太深。
任何粗暴的操作都可能物理性地破坏细胞膜,导致LDH假性释放,让你的数据“虚高”。
4 — Day 3/4: LDH反应与检测
提前将LDH检测试剂盒中的组分解冻至室温。
在检测前,根据样品数量新鲜配制LDH检测工作液。这个工作液必须现配现用,并且要避光。
向含有90 μL上清的新96孔板中,每孔加入45 μL新鲜配制的LDH检测工作液。(记住,上清和工作液的体积比通常是2:1)。
用多通道移液器轻柔吹打混匀,或在摇床上低速振荡几秒钟。注意避免产生气泡。
用铝箔包裹培养板避光,在室温(约25℃)下孵育30分钟。
孵育结束后,立即在酶标仪上测定490 nm处的吸光度(OD值)。
实验结果分析与预期
数据到手,咱们来算算细胞毒性。核心公式如下:
细胞毒性 (%) = [ (OD待测样本 - OD细胞自然死亡) / (OD最大酶活性 - OD细胞自然死亡) ] × 100%
在计算前,所有孔的OD值都应先减去“样品背景孔”(只有培养基)的OD值,以校正背景。
预期结果:随着药物浓度的增加或处理时间的延长,如果药物具有细胞毒性,你将会观察到OD值和计算出的细胞毒性百分比随之升高。
最终,你可以绘制药物浓度-细胞毒性曲线,并计算出半数致死浓度(IC50)。
注意事项与“彩蛋”
☞ 样品时效性
LDH酶在样品中并不绝对稳定。冷冻会使其失活,4℃也只能放2-3天。
所以,采集完上清后,最好当天就完成检测,别拖延!
☞ 气泡是天敌
在加样、混匀、转移上清的每一步都要避免产生气泡。
气泡会严重干扰酶标仪的读数,得到的数据可能就没法要了。
☞ 预实验的重要性
正式开始大批量筛选前,强烈建议先做一个预实验,摸索一下最佳的细胞铺板密度和药物处理时间。
这能帮你节省大量的时间和经费。
这个实验本身不复杂,但魔鬼藏在细节里。
严格按照步骤,注意对照的设置和操作的轻柔。
本文由环凯转载自“AIBio Research”公众号,版权归原作者(xichen)所有,仅供学习参考,如有侵权请联系删除!









