细胞代数,你真的会算吗?
发布时间:2025-05-19 浏览次数:48
取自动物并进行体外培养的细胞在其传代培养之前被称为原代细胞,当细胞维持一段时间的生长,达到一定密度以后就要被分离为2个或者多个培养皿培养,这个过程为传代培养,传代以后生长的细胞便是细胞系。
细胞周期:细胞“分裂”的旅程
在细胞培养领域,无论是科研还是生产,技术员和研究者常会遇到关于“细胞代数”的讨论,比如“P3代和P6代有何差异?”或“低代数是否更好?”这些问题看似简单,但背后涉及的生物学和工艺细节却不容忽视。今天,我们从细胞周期入手,结合培养条件,系统剖析“细胞代数”的定义、影响因素及其局限性,帮助大家更科学地理解这一指标。
要搞懂“细胞代数”,我们得先从细胞的“人生”说起——也就是细胞周期。简单来说,细胞周期就是一个细胞分裂成两个细胞的完整过程。这个过程分成四个阶段:
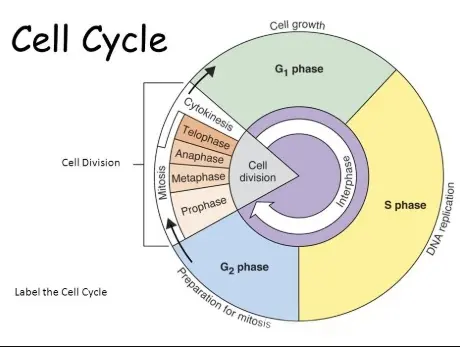
G1期(DNA合成前期):细胞刚分裂完,开始为下一次分裂做准备,忙着生长和合成蛋白质。
S期(DNA合成期):细胞开始复制DNA,把遗传信息翻倍,为分裂做好基础。
G2期(DNA合成后期):细胞检查DNA有没有出错,同时为分裂储备能量。
M期(有丝分裂期):重头戏来了!细胞一分为二,变成两个新细胞。
对于成体干细胞(比如MSC骨髓间充质干细胞或HSC造血干细胞),每经历一次分裂,它们就会“老”一点。分裂次数多了,细胞的活力会下降,甚至可能失去干细胞的“多能性”。这就像人一样,年轻时活力满满,但随着年龄增长,身体机能慢慢下降。所以,细胞分裂的次数(也就是周期数)直接关系到细胞的“健康状态”。
细胞代数:传代的定义与误区
在体外培养中,当细胞在培养容器中达到汇合后,转移至新容器的过程称为传代。每次传代,细胞代数(Passage number,如P1、P2)加1。然而,代数与分裂周期数并非等价,这一点常被误解。
传代的实际意义:代数仅记录“换瓶”次数,是操作层面的指标。
常见误区:很多人认为低代数(如P3)意味着分裂次数少,细胞更“健康”。但代数与周期数的对应关系受培养条件制约,二者并非简单线性相关。
要理解这种脱节,我们需要关注影响代数与周期关系的具体因素。
代数与周期的脱节:密度与工艺的影响
同一代数的细胞,其实际分裂周期数可能差异显著,主要由以下变量决定:
● 接种密度
高密度接种(如1×10⁶ cells/cm²):细胞分裂2-3次即可达到汇合,传代后为P1,周期数较少。
低密度接种(如1×10⁴ cells/cm²):细胞需分裂5-6次甚至更多才能汇合,传代后仍为P1,但周期数明显增加。
结论:高密度培养的P4代总周期数可能少于低密度培养的P3代,细胞状态差异显著。
● 培养工艺
培养基差异:不同配方(如含血清 vs. 无血清、添加生长因子如EGF或FBS浓度)会影响细胞增殖速率和周期长度。
环境变量:CO₂浓度、温度、氧张力等参数的波动,可能导致相同代数下周期数的差异。
传代策略:提前传代(70-80%汇合)与延迟传代(100%+汇合)会改变细胞的接触抑制状态和分裂需求。
因此,不同实验室或工艺下的细胞代数不具直接可比性。例如,某实验的P3代细胞可能经历了10次分裂,而另一实验的P6代仅分裂8次。单纯以代数评估细胞质量,显然缺乏依据。
超越代数:决定细胞状态的关键因素
细胞代数只是表层指标,真正决定细胞功能和应用价值的因素包括:
分裂周期总数:通过端粒长度检测(如TRF分析)或增殖标记(如Ki-67、BrdU染色)可更精确评估细胞衰老。
工艺参数:培养基优化、耗材选择(如聚苯乙烯 vs. 低附着表面)、传代酶(如TrypLE vs. 胰酶)直接影响细胞表型和功能。
环境控制:洁净度、恒温恒湿、机械应激(如离心速度)对细胞存活率和基因稳定性至关重要。
细胞类型:不同细胞系(如HeLa、CHO、原代细胞)的分裂耐受性和传代特性差异显著,需具体分析。
例如,某些永生化细胞系在高代数下仍保持增殖能力,而原代细胞可能在P5代即出现明显衰老。代数需结合具体细胞类型和检测数据综合评估。
技术建议:优化培养与评估
在细胞培养工作中,我们应避免对代数的过度依赖,采取以下策略提升研究或生产质量:
量化分裂周期:记录接种密度、汇合时间和预计周期数,必要时用CFSE染色或细胞计数验证实际分裂次数。
动态检测(金标准):定期进行检测克隆形成率:>70%为优质干细胞(CFU-F检测)衰老标记物:β-半乳糖苷酶阳性率<15%线粒体膜电位:JC-1红绿荧光比≥2.5
工艺优化:根据实验目标调整接种密度、传代频率和培养条件,避免因不当操作导致的功能丧失。
数据支持:在实验报告或生产记录中提供详细培养参数和质量检测结果,而非仅依赖“P几代”的模糊描述。
本文为网络转载,仅作分享交流,非商业用途,若涉侵权请联系删除。





