90色荧光液滴+光流控黑科技:一次实验跑完10万种微生物条件!
发布时间:2025-07-22 浏览次数:134 分享:
微生物检测现状与需求
传统微生物检测长期被“精度与效率不可兼得”的瓶颈束缚:摇瓶和微孔板操作繁琐,难以并行摸索成千上万种条件;液滴微流控虽能生成皮升级液滴,却常受限于“单一实验条件”。更棘手的是“观察与通量”两难——显微镜成像细节丰富,却只能逐帧捕捉数千个液滴;激光荧光检测速度飞快,却丢失了微生物在液滴内的空间分布信息。
2025年6月11日,德国Hans-Knöll研究所与耶拿大学团队在《Analyst》发表封面文章,报道了一套全新的“液滴-光流控”一体化平台。该平台首次将多重液滴制备、实时荧光编码识别与在线显微拍照结合在一起,让传统需要数天、分批进行的微生物实验缩短到数小时,并可在一次实验中轻松完成上万种条件的并行测试。
实验方法:多维度设计构建完整检测体系

图 1 集成平台的三阶段工作流程
如图1清晰呈现了技术的核心框架,分为多通道液滴库生成、培养和光流控检测三个阶段。
l 样本与试剂制备
碳源与染料:测试11种碳源(如葡萄糖、麦芽糖、氨基酸等),终浓度均为20 mg/mL;使用Alexa-flour 488、Alexa-flour 647、DY557三种染料,每种设2个浓度梯度,通过红、远红染料组合生成荧光条形码以标记不同碳源条件。
l 液滴生成与培养
多通道液滴库构建:借助自动化液体处理系统(MitosDropix)混合细菌、碳源与染料,生成皮升级液滴,每条件产4.5-6万个;通过荧光条形码区分11种碳源(各设2个重复)及2个对照,共24个实验条件。液滴在37℃动态培养24小时,模拟微生物生长环境。
l 光流控检测与分析
液滴注入定制芯片后,经405、561、639 nm激光激发,光纤收集荧光信号以识别条形码,下游相机触发流式成像,通过背景减除、边缘检测等算法量化细菌生物量(占液滴面积比例)。作为对比,部分液滴采用Zeiss Axio Observer Z1显微镜在10×放大倍数下成像,每视野约300个液滴,同样用于生物量量化。数据分析时,通过HDBSCAN聚类识别荧光条形码,并借助正态分布拟合过滤异常液滴(仅保留峰值宽度在十分之一最大值内的液滴)。
实验结果:方法可靠且效率显著提升
l 荧光条形码识别效果

图 2 荧光条形码聚类分析
经过滤算法处理后,光流控检测的荧光条形码聚类更集中(图2),与显微镜相比,因荧光信号为平均值且仅取峰值,聚类稳定性更高。
红、远红染料组合理论可生成90种条形码,实验中24种均被准确识别,24小时培养后仍稳定可辨(仅因液滴收缩略有强度偏移),误分类率仅2%。
l 生长量化与方法一致性
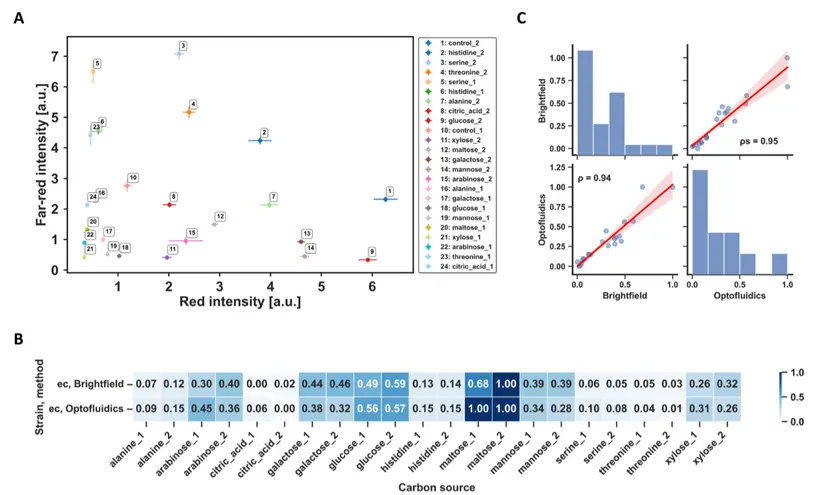
图 3 碳源利用实验对比
碳源利用实验显示:大肠杆菌在麦芽糖上生长最佳(生物量归一化值1.0),木糖最差(≈0.0),氨基酸作为唯一碳源时生长微弱(如丙氨酸≈0.05),与微生物代谢特性一致。
并且光流控与显微镜结果高度相关,皮尔逊相关系数0.94,斯皮尔曼相关系数0.95(图3),证明方法可靠性。
l 效率优势显著
光流控系统5分钟可分析超1万个液滴(速率≈60 Hz),显微镜8分钟仅能分析约6000个,且光流控液滴可完整回收用于后续实验,显微镜检测后液滴易受损。
研究亮点
该研究将“周级”实验压缩到“小时级”,过去需逐一测试的数十种碳源等条件,如今一次5分钟的芯片运行即可完成,时间成本降低1–2个数量级。
皮升级液滴使试剂与样本用量较传统减少百倍,降至纳升以下,缓解珍贵样本消耗压力。
90重荧光条形码确保每个液滴身份可追溯,解决多条件并行时的识别难题,可应用于抗生素敏感性测试等场景。
检测后液滴完整可回收,阳性样本能继续培养或进行组学分析,避免传统显微镜检测导致的信息丢失。
该平台可同时测试数千种条件,有助于捕获“不可培养”或低丰度微生物及活性产物,为环境微生物组与天然产物挖掘奠定基础。
原文链接:https://doi.org/ 10.1039/d5an00130g
来源:微生物安全与健康网,作者~肖锦琦。