研究生必备技能:细胞培养技巧(详解)
发布时间:2023-02-22 浏览次数:698
来源:科研小白的进阶之路
“ 可能你已经是实验室老江湖了,但谁不希望自己细胞养的好看一些呢?本文适用于已经进入实验室的小伙伴,没有原理,都是干货~ 建议认真阅读!”
01 — 基础操作
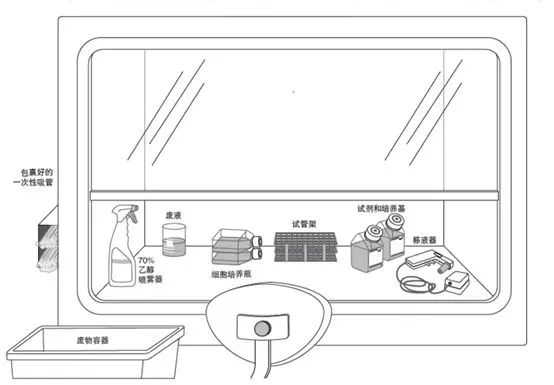
1. 适合惯用右手的超净台试剂布局
2. 对于新细胞心需要观察摸索最适的消化温度和时间,细胞间隙明显,大片脱落可移动即可终止消化。有些细胞消化后不会变圆形,半沙状即可;

3. 消化后需要轻轻拍打细胞壁面,震落细胞;
4. 离心速度不宜过大,1000rpm/min比较适宜
5. 离心后2 mL重旋,呈云雾状散开即可,吹散次数过多影响细胞活力,建议熟练操作;
6. 种板需一步完成,不可补加;
7. 长时间培养实验,最外圈应空出来,加入PBS或空白/阴性对照,以防培养基蒸发引起的边缘效应;
8. 把从液氮或-70℃水箱中取出的细胞在最短的时间内放入水浴锅中进行解冻。
9. 离心前须加入少量培养液。细胞解冻后二甲基亚砜(DMSO)浓度较高,注意加入少量培养液可稀释其浓度,以减少其对细胞的损伤。如果冻存液的浓度是10% DMSO,那么加10 ml以上的培养基就恰好稀释到了无害浓度。但培养基越少细胞越容易贴附。
10. 血清为混合物,不同品牌/批次存在差异,不同细胞适用血清品质存在差异,应做好细胞试用筛选工作,再囤积足够量;胎牛血清在-20℃保存可达5年。
11. 血清灭活处理:4℃溶解,置于56℃ 30 mins.如果血清灭活后有纤维蛋白析出,属正常现象;
12. 使用抗生素前,查询细胞相关培养特性,根据污染类型的鉴别,有针对性的处理;
13. -80℃冻存效果有限,根据研究需求,合理冻存,半年以上实验建议液氮冻存一批;
14. 根据不同的细胞类型选择冻存的细胞密度。必要的实验进行细胞最佳冻存密度测试。
典型的细胞冻存密度:1-10 ✕ 10^6 Cells/mL;
细胞长期高密度生长(长到90%-100%),更容易老化。且对数期细胞增殖速度快,容易聚团漂浮。应更具研究需要和细胞生长特性优化传代密度。
15. 细胞一旦分化/老化,很难逆转,无法通过外界营养体系和生长条件的改变“起死回生”。
16. 小心取用无菌实验物品,勿碰触吸管尖头部或容器瓶口,也不要在打开的容器正上方操作实验。容器打开后,以手夹住瓶盖并握住瓶身,倾斜约45°角取用,尽量勿将瓶盖盖口朝上放置桌面。
17. 每次操作只处理一株细胞株,且即使培养基相同也不共享培养基,以避免失误混淆或细胞间污染。实验完毕后,将实验物品带出工作台,以75%酒精擦拭无菌操作台面。操作间隔应让无菌操作台运转10分钟以上后,再进行下一个细胞株之操作。
18. 离心管、冻存管等容器需用抗酒精的标记笔标示内容物名称、操作日期、操作人员姓名。若是细胞传代培养,更需注明目前的代数,以及这是同一代中的第几盘。
19. 常用的生物安全柜应定期用75%酒精对内部工作区域表面、侧壁、后壁、窗户进行表面净化;二氧化碳培养箱用75%酒精喷洒消毒后擦干(每月一次);增湿盘换水(2周1次),蒸馏水漂洗后无纺布或纸擦干,用75%酒精喷洒消毒后擦干,可按比例添加Aquaguard-2支原体预防试剂(最好预热至37℃)。显微镜、离心机也应定期擦拭。
20. 在开始养细胞并传代时,也要特别注意冻存细胞,以保持细胞有种子库存在,可以有效避免细胞损伤。
21. 胰酶细胞消化液消化细胞时间不宜过长,否则细胞铺板后生长状况会较差,做流式时的CD Marker也可能会下降。胰酶进行分装时尽量分装成多瓶,并遵守3次左右用完和只装2/3体积的原则。因为冷冻保存时液体体积会膨胀,多次使用同一瓶胰酶反复冻融会降低消化效果并可能造成污染。胰酶适用于消化细胞间质较少的软组织和传代细胞,如胚胎、上皮、肝、肾等组织,但对于纤维性组织和较硬的癌组织效果较差。胰酶消化效果主要与pH值、温度、胰酶浓度、组织块大小和硬度有关。
02 — 常见问题解答
1. 细胞铺板后状态不好:可通过更换其他批次细胞系,优化胰酶消化条件,血清中和量和时间改善;
2. 细胞铺板不匀:消化过度容易造成细胞整片粘连,结团率高,很难通过吹打分散;不同细胞接种前,最好进行梯度吹打实验;加样从孔的左边靠底部缓慢加入;
3. 每孔之间细胞量不同:铺板速度尽量要快;每接几个孔细胞悬液需要混匀一下;加完半边板后,需要再次讲培养皿内剩余细胞悬液充分混匀后铺板。
4. 血清溶解后有絮状物:冷冻血清应置于4℃冰箱溶解,期间需均匀摇晃,溶解后按需分装冻存,避免反复冻融,不宜在4℃长期储存。血清的颜色依据血红蛋白含量不同而变化。
5. 细胞污染排查:培养试剂和辅助试剂等条件不变,重新复苏一株细胞,复苏时注意水浴不能没过冻存管瓶盖,传代时不能触碰吸管尖头部或容器瓶口。操作前需要用75%的酒精擦拭无菌操作台面。观察细胞是否有污染现象。
血清污染排查:其他试剂不变,仅更换血清。
基础培养基:其他试剂保持不变,仅更换基础培养基。
PBS:其他试剂保持不变,仅更换PBS。
胰酶:若细胞复苏的很好,一传代就污染,可以尝试其他试剂保持不变,仅更换消化用胰酶,看细胞状态。
耗材:培养基及辅助试剂等条件不变,使用新耗材(培养皿或培养瓶、枪头)培养细胞,观察细胞是否有污染。
6. 细胞不贴壁:胰酶消化时间不当。时间短,易成团;胰酶处理太久,易造成细胞膜蛋白损伤,严重导致细胞死亡。
缺少贴壁因子:血清中含有促贴壁因子,无血清培养基,细胞贴壁效果下降很多。
其他原因:支原体或细菌污染;细胞状态不好,细胞老化;接种细胞数目少;复苏时处理速度太慢;培养液配制储存不当(eg:pH过碱,Gln太少)。
解决方法:

贴壁变差:可适当加高血清比例(最高不超过20%);建议试好一个血清批次多囤一些,可以避免血清批间差对细胞的影响。
7. 细胞老化怎么办?
防止细胞老化最主要还是要做到勤观察、勤换液、勤传代、勤保种,特别是传代,不能等细胞太密了之后传,一般细胞建议长到70%融合度传代最好;
换培养液应该根据自己细胞消耗培养基的情况来确定是否该换。如果感觉时间不好把握的话就多培养几瓶细胞,在不同的时间换液,最后再来比较下,看什么时候换液好,得出自己的结论;
选择正确的血清与培养基:细胞对血清特别敏感,直接影响细胞的生长。一定要选择适合的血清不然就会因营养物质不协调而导致细胞老化;
在间充质干细胞培养时必然要进行消化,但是消化对细胞的表面蛋白质有很强的破坏作用,因此不能长时间进行消化并且在选择消化酶时也要选择较为合适的pH和浓度,不然就会使细胞老化或者分化;
8. 293细胞感染病毒后凋亡严重:
通过更换血清批次,再进行转染实验并观察转染后的效果,比较分析出原因。
293传代:鉴于该细胞贴壁疏松,普通0.25%胰酶消化时间控制15s-30s;吹打动作轻柔,控制在10-20次;细胞融合率达到80%传代即可传代,不可长的太满。
9. 血清浑浊怎么办?
血清产品中出现沉淀属于常见现象,无需过多担心,并且不会影响血清的品质,对细胞培养而言也是没有任何问题的,可放心使用。若想去除沉淀,我们建议您采用2000 rpm 离心5分钟,或用0.45 μm的过滤器去除沉淀。
03 — 新手注意事项
1. 水浴锅未提前预热或者未预热到37℃直接融化。
2. 水浴锅内冻存管太多,导致传热不佳,使融化时间延长。
3. 离心前忘记平衡,导致离心机损坏和细胞丢失。
4. 一次复苏细胞种类过多,忘记更换吸头和吸管,导致细胞交叉污染。
5. 判断细胞复苏成功与否,需要看复苏后细胞贴壁率及细胞存活率。
定期检查培养细胞的形态(即形状和外观)
① 细胞形态变化的迹象:细胞核旁颗粒的堆积、细胞质中有空泡、细胞团缩并从平板上脱离、外形变化
② 细胞形态变化原因:培养基改变、细胞污染、细胞老化、有毒物质
PH值降升高:
完全培养基尽量现配现用,2~8℃下避光保存一周内使用完;避免操作时间过长。操作时间快速、减少同时进行的实验数量。
PH值降低:
① 及时传代、提高传代比例或降低血清量;
② 适当松开瓶盖;
③ 增加培养液中NaHCO3浓度或减少培养箱内CO2浓度(NaHCO3含量在2.0 g/L到3.7 g/L之间时,对应的CO2浓度为5~10%);
④若是微生物污染造成的,需及时丢弃培养基,并对操作、培养空间进行消毒处理。
引用:[1] 本文内容来自于逍鹏生物,逍鹏生物对外泌体和细胞3D培养有相关经验分享。

说明:转载只为分享目的,如有侵权请联系删除,谢谢!





